Uno de los mayores desafíos en el cultivo in vitro es la contaminación, por eso es importante identificar los contaminantes más comunes cuanto antes.
En este capítulo aprenderemos a identificar los contaminantes más comunes, comprender cómo llegan al medio de cultivo y diferenciar sus manifestaciones visibles.
Con esta información, estarás mejor preparado para ajustar tus protocolos de desinfección y prevenir futuras contaminaciones.
📖 Serie: Desinfección para cultivo in vitro de semillas y tejidos vegetales
Capítulo 2 – Principales contaminantes en cultivo in vitro y cómo identificarlos

INDICE
- Introducción
- Tipos de contaminantes más comunes
- Cómo llegan los contaminantes a tu cultivo
- Cómo identificarlos a tiempo
- Consejos prácticos
- Resumen del capítulo
🌱 Introducción


Uno de los mayores desafíos en el cultivo in vitro es, sin duda, la contaminación microbiana.
Incluso cuando seguimos los protocolos al pie de la letra, los microorganismos pueden encontrar la forma de infiltrarse en nuestros frascos.
Reconocerlos a tiempo es fundamental para actuar antes de que se propaguen y comprometan toda la partida.
Este problema, aunque previsible, es muchas veces inevitable si no se dominan las técnicas y condiciones que garantizan la asepsia.
El cultivo in vitro, por su propia naturaleza, ofrece a los microorganismos un entorno ideal para proliferar: un medio de cultivo rico en nutrientes, con azúcares fácilmente metabolizables, humedad constante y temperaturas moderadas.
Estas condiciones, diseñadas para favorecer el desarrollo vegetal, también constituyen un caldo de cultivo perfecto para hongos, bacterias y levaduras.
Lo más preocupante es que la contaminación puede presentarse incluso cuando se siguen los protocolos establecidos de forma meticulosa.
Esto ocurre porque las esporas fúngicas y las bacterias son extremadamente pequeñas, ligeras y resistentes, pudiendo llegar al frasco por múltiples rutas: desde restos en la superficie del material vegetal, con las semillas, hasta el aire circundante, herramientas insuficientemente esterilizadas o soluciones contaminadas.
La realidad es que ningún sistema es 100 % infalible.
Por ello, más allá de aplicar las técnicas correctas, es imprescindible desarrollar la habilidad de detectar de forma temprana cualquier signo de contaminación.
Una observación minuciosa y periódica del material cultivado puede marcar la diferencia entre rescatar parte de una remesa o perderla por completo.


En este capítulo profundizaremos en:
- La identificación visual y morfológica de los contaminantes más comunes.
- El análisis de las principales vías de ingreso al medio de cultivo.
- La diferenciación entre contaminaciones tempranas y tardías.
- Estrategias para ajustar protocolos de desinfección en función de la causa probable.
Con esta información no solo podrás reconocer un frasco contaminado a simple vista, sino también anticipar y reducir la probabilidad de que vuelva a ocurrir en futuros cultivos.
Este conocimiento es esencial para optimizar tus recursos, proteger tu trabajo y garantizar la viabilidad de cada lote sembrado.
🔍 Tipos de contaminantes más comunes


1. Hongos filamentosos


- Aspecto: manchas o parches algodonosos, de color blanco, gris o verde, que crecen rápidamente.
- Velocidad de crecimiento: muy alta, en 24–48 horas pueden cubrir toda la superficie del medio.
- Origen más probable: esporas transportadas por el aire, restos en el material vegetal o contaminación cruzada desde herramientas.
- Consecuencia: sofocan las plántulas y alteran la composición del medio, provocando su muerte.
2. Bacterias
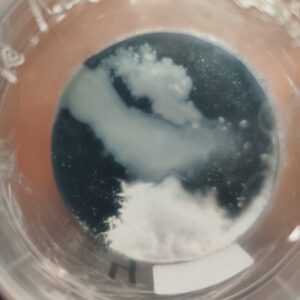
- Aspecto: zonas acuosas, mucilaginosas o brillantes; pueden presentar colores amarillos, anaranjados o transparentes.
- Velocidad de crecimiento: extremadamente rápida, a menudo visible en menos de 24 horas.
- Origen más probable: restos en la superficie de semillas, manipulación sin esterilidad suficiente, agua o soluciones contaminadas.
- Consecuencia: consumen nutrientes y liberan toxinas que dañan el tejido vegetal.
3. Levaduras


- Aspecto: colonias pequeñas, cremosas, blanquecinas o rosadas, de bordes definidos.
- Velocidad de crecimiento: moderada, visible en 2–5 días.
- Origen más probable: contaminación aérea o residuos en material vegetal.
- Consecuencia: aunque menos agresivas que los hongos, pueden alterar el pH del medio y ralentizar el crecimiento vegetal.
4. Virus
Tipos de contaminación viral más comunes
Los virus que más afectan a las orquídeas en cultivo incluyen:
- Virus del mosaico del cymbidium (CyMV)
- Virus del rayado de la orquídea (ORSV)
- Virus del mosaico del tabaco (TMV)
- Virus del mosaico del pepino (CMV)
En un cultivo In vitro es poco probable que se de una infección por virus que afecten a plantas de orquideas, por ejemplo de los mencionados anteriormente, a menos que los tejidos, capsulas o semillas estuvieran previamente contaminados y no se haya realizado una desinfección previa correcta.

Riesgos y peligros para el cultivo ex vitro:
Para el cultivo ex vitro:
- Pérdida total o parcial de la producción
- Plantas débiles con crecimiento anormal
- Transmisión a otras plantas del laboratorio
- Contaminación de medios de cultivo
Económicos:
- Inversión perdida en tiempo y recursos
- Posible cierre temporal del laboratorio
- Pérdida de material genético valioso
Pautas de seguridad esenciales
Prevención primaria para el uso de tejidos o semillas
- Selección de plantas madre: Usar solo plantas madre certificadas libres de virus
- Análisis previos: Realizar pruebas serológicas (ELISA) o PCR antes del cultivo
- Cuarentena: Mantener plantas nuevas aisladas antes de usarlas como fuente

Higiene del laboratorio
- Esterilización completa: Todos los instrumentos deben esterilizarse entre cada manipulación
- Cambio de guantes: Usar guantes nuevos para cada planta o lote
- Desinfección de superficies: Limpiar mesas de trabajo con etanol al 70%
- Flujo laminar: Trabajar siempre bajo campana de flujo laminar
Protocolos de trabajo
- Separación física: Mantener cultivos sospechosos alejados de materiales limpios
- Orden de manipulación: Trabajar primero con material libre de patógenos
- Documentación: Registrar el origen y tratamiento de cada cultivo
- Personal capacitado: Solo personal entrenado debe manipular los cultivos
Detección temprana
- Inspección visual regular: Buscar síntomas como mosaicos, decoloraciones o deformaciones
- Pruebas diagnósticas periódicas: Especialmente en cultivos de alto valor
- Aislamiento inmediato: Separar cualquier material sospechoso
En caso de contaminación
- Destrucción segura: Incinerar o autoclave todo el material contaminado
- Desinfección profunda: Limpiar completamente el área de trabajo
- Revisión de protocolos: Identificar y corregir fallos en los procedimientos
- Cuarentena extendida: No usar el espacio hasta confirmar que está libre de patógenos
La contaminación viral en cultivos de orquídeas es un problema serio pero manejable con las precauciones adecuadas.
La prevención es siempre más efectiva y económica que el tratamiento posterior.
Virus Humanos
Los virus humanos comunes como gripe, COVID-19, varicela, sarampión, etc. no pueden contaminar ni afectar los cultivos in vitro de orquídeas, aunque si se pueden desarrollar en el medio de cultivo.
Te explico por qué:
Especificidad de huésped
Los virus son altamente específicos en cuanto a las especies que pueden infectar:
- Virus humanos: Están adaptados exclusivamente para infectar células humanas y algunos mamíferos relacionados
- Virus de plantas: Solo pueden infectar células vegetales
- Barrera biológica: No existe compatibilidad celular entre virus humanos y plantas
Diferencias fundamentales. Estructura celular
- Células humanas: Son eucariotas animales con receptores específicos para virus humanos
- Células vegetales: Tienen pared celular, cloroplastos y receptores completamente diferentes
- Incompatibilidad: Los virus humanos no pueden reconocer ni adherirse a células vegetales
Mecanismos de infección
- Los virus humanos necesitan enzimas y estructuras celulares específicas que solo existen en células animales
- Las plantas tienen sistemas de defensa únicos que son irrelevantes para virus humanos
Precauciones de laboratorio
Ahora bien, aunque los virus humanos no afectan las orquídeas, sí hay razones para mantener higiene:
Contaminación indirecta
- Virus, Bacterias y hongos: Una persona enferma puede introducir patógenos que sí afecten las plantas o al medio de cultivo.
- Higiene general: Mantener el ambiente estéril es fundamental
Buenas prácticas
- Mascarillas: Previenen la proyección de saliva y partículas
- Lavado de manos: Elimina microorganismos que podrían contaminar medios
- Personal enfermo: Evitar que trabajen en el laboratorio por riesgo de contaminación bacteriana/fúngica
Los virus humanos como gripe, COVID-19, varicela o sarampión no representan ningún riesgo directo para los cultivos de orquídeas debido a la especificidad de huésped.
Sin embargo, mantener protocolos de higiene estrictos sigue siendo importante para prevenir contaminaciones por otros microorganismos que sí podrían afectar los cultivos.
La separación evolutiva entre virus de plantas y animales es tan antigua que no existe ningún mecanismo por el cual estos virus puedan «saltar» entre estos grupos tan diferentes de organismos. De momento …
📌 Cómo llegan los contaminantes a tu cultivo

Incluso con una preparación cuidadosa, existen múltiples vías por las que los contaminantes pueden introducirse:
- Material vegetal insuficientemente desinfectado – La causa más común.
- Manipulación en un entorno no estéril – Trabajar en espacios abiertos o sin protección de flujo laminar aumenta el riesgo.
- Instrumental mal esterilizado – Pinzas, bisturís o recipientes sin la limpieza adecuada.
- Soluciones y agua contaminadas – Uso de reactivos o agua no tratada con calor o filtración.
- Contaminación cruzada – Abrir frascos cerca de otros cultivos o reutilizar materiales sin limpieza completa.
🧼 Ampliación: Preparación inicial para mitigar la contaminación
El protocolo de acciones preventivas frente a la contaminación en cultivo in vitro comienza antes de tocar cualquier semilla, herramienta o frasco.
La prevención no se basa únicamente en la esterilización de los materiales, sino en una cadena de medidas higiénicas y de control ambiental que, combinadas, reducen drásticamente el riesgo de introducir microorganismos en el sistema de cultivo.
El primer paso fundamental es el lavado meticuloso de las manos con jabón antibacteriano, realizando una fricción de al menos 20–30 segundos, asegurando la limpieza de uñas, espacios interdigitales y muñecas.
Aunque posteriormente se utilicen guantes, este procedimiento inicial elimina la mayor parte de la microbiota cutánea y la suciedad superficial que podrían comprometer la esterilidad.
A continuación, se requiere vestimenta limpia y dedicada exclusivamente a la manipulación de material estéril.
Esto incluye bata o chaqueta de laboratorio libre de pelusas, preferiblemente de tejido antiestático, para minimizar la liberación de partículas al aire.
El uso de mascarilla no es un mero formalismo: reduce de forma significativa la dispersión de microgotas respiratorias que pueden transportar bacterias y esporas fúngicas.
En entornos de alta exigencia, el empleo de mascarillas quirúrgicas de tres capas o respiradores N95 añade una barrera adicional frente a contaminantes aéreos.
Los guantes deben ser de nitrilo o látex sin polvo, desinfectados externamente con alcohol isopropílico al 70 % antes y durante la manipulación.
Complementariamente, los manguitos protectores evitan que las mangas entren en contacto con la zona de trabajo o el material cultivado, especialmente en cabinas o glovebox.
Finalmente, la zona de trabajo debe ser rigurosamente desinfectada antes de iniciar cualquier procedimiento.
Esto incluye la limpieza de superficies con soluciones de hipoclorito de sodio, alcohol al 70 % o agentes de amplio espectro, así como el control de corrientes de aire y polvo en suspensión.
Si se dispone de cabina de flujo laminar o glovebox, estas deben ponerse en funcionamiento, higienizar y purgar el aire durante el tiempo recomendado, al menos 20 minutos, antes de introducir el material.
El uso de lámparas germicidas —generalmente de emisión ultravioleta tipo C (UV-C)— constituye una herramienta altamente efectiva para complementar los procedimientos de desinfección en entornos de cultivo in vitro.
Estas lámparas emiten radiación en el rango de 200 a 280 nanómetros, siendo 254 nm la longitud de onda más utilizada por su máxima eficacia germicida.
La radiación UV-C actúa alterando el ADN y el ARN de microorganismos como bacterias, virus, hongos y esporas, provocando daños irreversibles que impiden su reproducción y, por ende, su proliferación.
Esto convierte a las lámparas germicidas en un recurso valioso para reducir la carga microbiana en el aire, las superficies de trabajo y los instrumentos no sensibles a la luz ultravioleta.
En el contexto del cultivo in vitro, su empleo previo a las manipulaciones —por ejemplo, encendiendo la lámpara en la glovebox, cabina de flujo laminar o habitación de trabajo durante 15–30 minutos antes de comenzar— aumenta la eficacia global del protocolo de asepsia al eliminar una parte significativa de los contaminantes residuales que podrían resistir la limpieza química.
No obstante, el uso de lámparas germicidas requiere precauciones estrictas:
- Nunca debe exponerse piel o ojos directamente a la radiación UV-C, ya que puede causar lesiones.
- Deben emplearse temporizadores o encendidos programados para evitar la presencia humana en la zona de irradiación.
- Es recomendable combinarlas con ventilación controlada para dispersar el ozono generado por ciertos modelos de lámparas.
En conjunto, la integración de esta tecnología dentro del protocolo de preparación del área de trabajo no sustituye, sino que potencia las técnicas de desinfección física y química tradicionales, proporcionando un nivel adicional de control frente a la contaminación microbiana.
Este conjunto de medidas, aplicadas de forma sistemática, establece un entorno controlado y de bajo riesgo microbiológico, que constituye la base indispensable para cualquier protocolo de cultivo in vitro exitoso.
🧪 Cómo identificar a tiempo la contaminación

Detectar la contaminación en las primeras fases del cultivo in vitro es crucial para evitar que se propague y comprometa toda la partida.
La clave está en combinar una observación sistemática con el conocimiento de los signos característicos de cada tipo de contaminante.
- Inspección diaria: los primeros 7 días después de la siembra son críticos; revisa los frascos a diario.
- Análisis visual: aprende a reconocer texturas, colores y patrones de crecimiento.
- Análisis olfativo (con precauciones de seguridad) un olor agrio, mohoso o fermentado indica contaminación bacteriana o fúngica.
- Registro fotográfico: tomar fotos periódicas permite comparar cambios y detectar contaminación temprana.
1. Inspección diaria
Los primeros 7 días posteriores a la siembra representan la etapa de mayor vulnerabilidad.
Durante este periodo, las esporas fúngicas o bacterias presentes en el material vegetal pueden multiplicarse rápidamente y manifestarse de forma visible.
Revisar los frascos a la misma hora cada día permite detectar cambios sutiles en el medio de cultivo o en el tejido vegetal.
La observación debe realizarse con luz blanca intensa y, preferiblemente, sobre un fondo neutro que facilite el contraste.
2. Análisis visual
El ojo entrenado es una de las herramientas más valiosas en la prevención de pérdidas.
Es fundamental aprender a identificar:
- Texturas anómalas: presencia de masas algodonosas (hongos filamentosos), mucosidad brillante (bacterias) o colonias cremosas (levaduras).
- Colores inusuales: el medio debe mantener su color original; la aparición de tonos grises, verdes, negros, amarillentos o rosados indica actividad microbiana.
- Patrones de crecimiento: los hongos suelen expandirse de forma radial desde un punto inicial, mientras que las bacterias tienden a dispersarse en zonas acuosas y difusas.
3. ⚠️ Análisis olfativo (con precauciones de seguridad)
El olfato puede ser un indicador temprano y complementario a la inspección visual para detectar contaminación.
Algunos microorganismos producen compuestos volátiles característicos que delatan su presencia:
- Hongos: olor a humedad intensa o “moho viejo”.
- Bacterias: olor agrio, fermentado o a descomposición vegetal.
Sin embargo, esta técnica implica riesgos para la salud.
Al abrir un frasco contaminado se liberan esporas, aerosoles y compuestos orgánicos volátiles que, al ser inhalados, pueden provocar:
- Irritación de vías respiratorias.
- Reacciones alérgicas o crisis asmáticas.
- Sensibilización crónica tras exposiciones repetidas.
- Infecciones oportunistas en personas con defensas bajas.
Medidas de bioseguridad recomendadas:
- Realizar la apertura únicamente si es imprescindible y lejos de cultivos sanos.
- Usar mascarilla N95 o FFP2 para filtrar partículas y esporas.
- Manipular el frasco dentro de una cabina de bioseguridad o en un área bien ventilada.
- Desechar inmediatamente el material contaminado utilizando métodos seguros (autoclave, incineración o desinfección química de alta eficacia).
Nota: El análisis olfativo no debe considerarse un método primario de diagnóstico, sino un recurso puntual de confirmación cuando se cuenta con condiciones seguras de manipulación.



4. Registro fotográfico
Documentar el aspecto de los frascos desde el momento de la siembra permite comparar cambios con precisión.
Una serie fotográfica, tomada cada 24 horas durante la primera semana y luego cada 2–3 días, facilita la detección de variaciones sutiles en color, transparencia o estructura del material vegetal.
El uso de macros o lentes de aumento mejora la capacidad de identificar contaminantes en estadios iniciales.
En conjunto, la aplicación de estas cuatro prácticas —inspección diaria, análisis visual, control olfativo y registro fotográfico— no solo mejora la detección temprana de la contaminación, sino que también permite retroalimentar y optimizar los protocolos de desinfección para futuras siembras.
💡 Consejos prácticos

- Trabaja siempre en condiciones de esterilidad: glovebox, cabina de flujo laminar o zona cerrada y desinfectada.
- Utiliza reactivos frescos y no reutilices soluciones de desinfección.
- Esteriliza el instrumental con llama o calor seco antes de cada manipulación.
- Nunca abras un frasco contaminado cerca de cultivos sanos.
- Previamente al cultivo, realiza prueba del tetrazolio
La prueba del tetrazolio (específicamente con cloruro de 2,3,5-trifeniltetrazolio o TTC) es una herramienta muy útil en el cultivo in vitro de orquídeas.
Te explico sus aplicaciones y procedimientos:
¿Qué es y cómo funciona?
El tetrazolio es un compuesto incoloro que se reduce a formazán rojo en presencia de enzimas deshidrogenasas activas, indicando tejido vivo y metabólicamente activo.
Reacción: TTC (incoloro) + enzimas → formazán (rojo) + productos
Aplicaciones en cultivo de orquídeas
1. Viabilidad de semillas
- Prueba rápida: Determina qué semillas están vivas antes del cultivo
- Ahorro de tiempo: Evita sembrar semillas muertas
- Porcentaje de germinación: Estima el potencial germinativo del lote
2. Evaluación de explantes
- Tejidos viables: Identifica zonas vivas en meristemos o protocormos
- Selección de material: Elige los mejores explantes para subcultivo
- Daño por tratamientos: Evalúa efectos de desinfección o almacenamiento
3. Detección de contaminación. Identificar los contaminantes más comunes
- Diferenciación: Distingue entre crecimiento de la planta y microorganismos
- Zonas necróticas: Identifica áreas muertas por patógenos
Protocolo básico
1. Preparación de la solución
- Concentración: 0.1-1% de TTC en agua destilada
- pH: Ajustar a 7.0-7.4
- Preparación fresca: Usar inmediatamente o guardar en oscuridad
2. Procedimiento
- Sumergir: Colocar semillas/tejidos en solución TTC
- Incubar: 2-24 horas a 25-30°C en oscuridad
- Observar: Tejido vivo se tiñe de rojo/rosa
- Evaluar: Contar semillas/zonas teñidas vs. no teñidas
3. Ventajas específicas para orquídeas
- Las semillas de orquídeas son muy pequeñas y difíciles de evaluar visualmente
- El tetrazolio permite identificar rápidamente cuáles están vivas
4. Limitaciones y consideraciones
- Falsos positivos: Algunas bacterias también reducen TTC
- Falsos negativos: Tejidos dormantes pueden no reaccionar inmediatamente
- Concentración crítica: Muy alta puede ser tóxica, muy baja no da señal clara
5. Interpretación.
- Intensidad del color: Mayor actividad metabólica = color más intenso
- Distribución: Patrón de tinción indica zonas más viables
- Tiempo de exposición: Debe optimizarse para cada tipo de material
Protocolo específico para orquídeas:
Para semillas
- Hidratar semillas 24h en agua estéril
- TTC al 0.5% por 4-6 horas a 28°C
- Observar bajo microscopio: embrión rojo = viable
Para protocormos
- TTC al 0.1% por 2-4 horas
- Evaluar zonas de crecimiento activo
- Seleccionar los más intensamente teñidos para subcultivo
La prueba del tetrazolio es especialmente valiosa en orquídeas debido a la dificultad de evaluar la viabilidad de sus diminutas semillas y la importancia de optimizar cada paso del costoso proceso de cultivo in vitro.
📚 Resumen del capítulo

La contaminación es el enemigo silencioso del cultivo in vitro.
Detectarla a tiempo y entender su origen te permitirá mejorar tus protocolos de trabajo.
En el siguiente capítulo, (3), abordaremos el listado de materiales, reactivos y equipos básicos para llevar a cabo una desinfección efectiva en entornos domésticos y semiprofesionales.
Si tienes alguna duda o quieres saber más sobre Orquídeas, Cultivo Invitro, Terrarios o Jardinería en general, déjanos tu comentario y te ayudaremos lo antes posible.
Recuerda suscribirte al boletín de noticias y a nuestro canal en YouTube: @Gadesplant.
Síguenos en Facebook en facebook.com/GadesPlant para más contenido exclusivo.
Consultar nuestra sección de FAQS– Preguntas Frecuentes.




1 comentario en «🌺Protocolo Desinfección para cultivo in vitro de semillas y tejidos vegetales (II)»